所谓疫苗,是指为预防、控制疾病的发生、流行,用于人体免疫接种的预防性生物制品。天花和牛痘的故事妇孺皆知,英文“疫苗”(Vaccine)一词的来源就是拉丁文的“牛痘”(Vaccinia)。疫苗技术的问世,成为了人类医疗历史上一个重要的里程碑。
疫苗的研发到上市,需要满足很多法定的实体和程序性要求,这是对科学尊重和对生命敬畏的一种立法体现,但是如果出现了类似于此次疫情的重大公共卫生事件,常规程序下的疫苗审批上市及批签发是难以满足疾病防控需求的,那么在这样的一种情况下有没有特殊的规定呢?


所谓“附条件审批制度”,根据《疫苗管理法》第20条第一款规定,“应对重大突发公共卫生事件急需的疫苗或者国务院卫生健康主管部门认定急需的其他疫苗,经评估获益大于风险的,国务院药品监督管理部门可以附条件批准疫苗注册申请。”所谓“紧急使用制度”,根据《疫苗管理法》第20条第二款规定“出现特别重大突发公共卫生事件或者其他严重威胁公众健康的紧急事件,国务院卫生健康主管部门根据传染病预防、控制需要提出紧急使用疫苗的建议,经国务院药品监督管理部门组织论证同意后可以在一定范围和期限内紧急使用”。即紧急使用疫苗的建议权在国家卫健委手中,而审批权限则由国家食药监局掌握。
附条件审批制度规定使用的前提是有重大突发公卫事件急需的疫苗,或者是卫健部门认定的急需疫苗,在药监部门经过医疗评估能够确定获益大于风险的,药监部门可以附条件的批准疫苗的申请。所以我们可以看到,附条件批准的机构是国家药监部门。关于紧急使用制度中一定范围和期限内紧急使用的前提是,如果出现了特别重大的突发公共卫生事件,或者其他严重威胁了公众健康的紧急事件,那么国家卫健部门会提出紧急使用疫苗的建议,最终由国家药监部门在论证以后,可以同意该疫苗在一定的范围和期限内进行紧急的使用。
三、目前新冠疫情是否适用于附条件审批和紧急使用制度?结合新冠肺炎的相关情况,国家卫生健康委(以下简称“国家卫健委”)在今年1月20日的时候正式发布了《中华人民共和国国家卫生健康委员会公告》(2020年第1号),该公告明确两点,一是经报国务院批准同意,国家卫健委决定将新冠肺炎纳入法定传染病乙类【1】管理,采取甲类传染病的预防、控制措施。二是将新冠肺炎纳入国家卫生检疫法规定的检疫传染病【2】管理。2020年1月30日,世界卫生组织(WHO)宣布将我国新冠病毒疫情列为“国际关注的突发公共卫生事件”(PHEIC)。2020年3月11日,WHO总干事称新冠肺炎从特征上可称为“大流行”【3】。现在为止,全国大部分省份已经根据《国家突发公共卫生事件应急预案》的相关规定,启动了重大突发公卫事件的一级响应,也就是说将新冠病毒引发的疫情确立为了“特别重大突发公共卫生事件”【4】。故目前新冠肺炎属于法定的乙类传染病,由此引发的疫情属于“特别重大突发卫生事件”,那么根据现在的疫情形势,附条件批准新冠病毒疫苗的注册、根据疫情的情况,卫健部门认为有必要时都均可以提出一定范围内或者是期限内紧急使用的建议,最终由国家药监部门论证确同意。
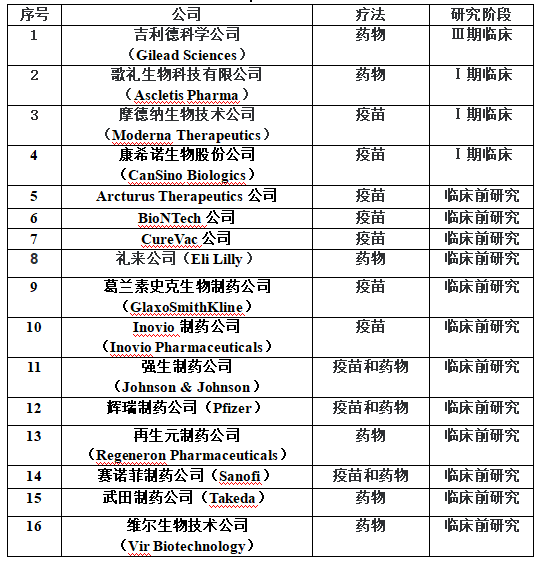
纵观疫苗管理法及相关规定,对于附条件审批只是做了一个原则性的规定,并没有更细化更明确的配套细则。而根据对《疫苗管理法》条文的理解,一定前提下药监部门的“附条件批准”是限于“疫苗注册申请”的,也就是说仅在疫苗注册环节可以适用该项制度,而疫苗的临床前研究和必要的临床试验阶段仍是必不可少的,这也是为了保障疫苗的安全性和有效性。针对本次新冠病毒疫苗,下图为目前疫苗的研发进展【5】。



 Home > News & Deals >
Home > News & Deals >


